珈创生物 —— 生物技术服务与研发为一体的高新技术企业
优质高效透明
High quality, efficient and transparent
发布时间:2023-02-02 09:07 信息来源: 阅读次数: 次
2020版中国药典(ChP)虽然并未收录NAT法作为支原体检测方法,但其中也提到了“也可采用经国家药品检定机构认可的其他方法”。传统的培养法和DNA染色法虽然有着自身的优点,但较长的检测周期和较大的样品检测用量逐渐不能满足行业快速发展的需求。NAT方法从当前支原体快速检测方法中脱颖而出,已经被美国药典、欧洲药典和日本药典收录,并明确提到NAT方法在经过适当验证后,可用于检测方法补充或替代药典方法进行放行检测。
下表为传统的支原体检测方法单次检测对应样品量和检测周期:
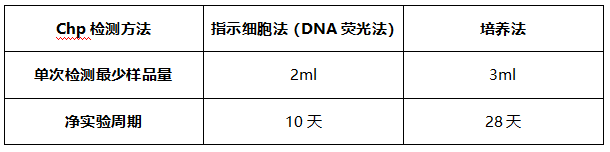

相对于传统方法,Q-PCR方法只需要很少的样品量(视灵敏度调整,按USP示例,最少可为0.2ml),若结果为阴性最快可以在24h内汇报结果。但是容易受到其他因素干扰导致出现“假阳性、假阴性”结果,所以针对该方法的验证工作极为重要。NMPA于2017年发布了《细胞治疗产品研究与评价技术指导原则》,提出可以采用快速、微量的新型检测方法。研究者应对新型检验方法与传统检测方法进行比较和评估,必要时,在产品放行检验时可以采用两种检验方法进行相互验证。
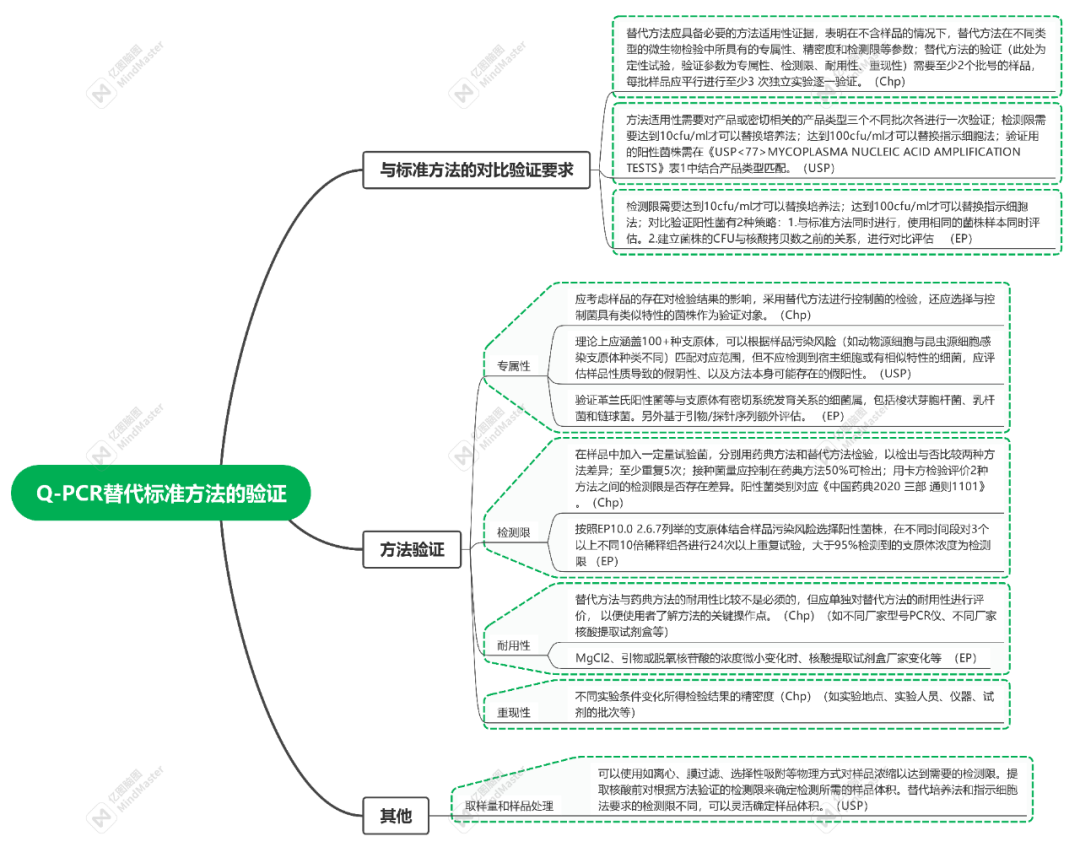
NAT法-方法验证要求
对于如何进行NAT方法的验证,目前欧洲药典<2.6.7>和日本药典里都详细介绍,其内容基本一致。中检院也发表了文章《支原体检查的核酸检测方法及方法学验证的思考》,以期对我国支原体核酸扩增法检测的研发者及使用者提供借鉴。支原体NAT法须进行专属性(Specificity)、检测限(Detection Limit)和耐用性(Robustness)验证。
后台回复“导图”,获取详细思维导图
法规要求
● 2020版中国药典三部《生物制品生产检定用动物细胞基质制备及质量控制》中提出对于生产用细胞,需要对主细胞库(MCB)、工作细胞库(WCB)、生产终末细胞(EOPC)进行支原体检查;通则9201 药品微生物检验替代方法验证指导原则
● 《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》中建议在关键时间点对适合的中间样品开展支原体等安全性相关检测或采取相关的措施加以控制,并且支原体同样需要作为终产品的放行检项
● FDA,Guidance for Industry:Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications,中提出对于原材料、病毒种子、未加工的收获液等都需要进行支原体控制
● EP 10.0 2.6.7 Validation of nucleic acid amplificationtechniques (NAT) for the detection of mycoplasmas: guidelines
部分图文来源于网络,侵联删
关于武汉珈创
武汉珈创生物技术股份有限公司,创建于2011年,是一家集生物技术服务与研发为一体的高新技术企业,专注于为生物药品/制品的生产企业及研发机构提供各类细胞(含重组细胞、干细胞、免疫细胞等)及原辅料的质量检测、病毒清除工艺验证技术服务。
END
