珈创生物 —— 生物技术服务与研发为一体的高新技术企业
优质高效透明
High quality, efficient and transparent
发布时间:2023-02-02 08:48 信息来源: 阅读次数: 次
本文将重点回顾12月,国内及国际生物药行业相关药政文件的发布情况,助力从业者更快掌握法规及监管动态。
国内药政
01.【药典会】 关于 WHO INN Plist127 生物制品通用名称的公示
2022年12月8日,国家药典委员会官网发布《关于WHO INN Plist127生物制品通用名称的公示》,经第十二届药典委员会相关专业委员会审核,对世界卫生组织(WHO)国际非专利名称(INN)建议目录127(Plist127)中收录的生物制品中文通用名称予以确定。为确保上述通用名称的准确性、合理性和唯一性。该公示征求社会各界意见,公示期自发布之日起一个月。
02.【NMPA】公开征求《药品标准管理办法(征求意见稿)》意见
2022年12月14日,NMPA官网发布公开征求《药品标准管理办法(征求意见稿)》意见,该管理办法旨在进一步规范和加强药品标准管理,保障药品安全性、有效性和质量可控性。现向社会公开征求意见,公开征求意见的时间为2022年12月15日至2023年1月14日。
03. 【药典会】关于发布《中国药典》(2025年版) 编制大纲的通知
2022年12月8日,国家药典委员会官网发布关于《中国药典》(2025年版)编制大纲的通知,根据《药品管理法》《疫苗管理法》等法律法规的规定,制定本大纲旨在贯彻落实《中华人民共和国国民经济和社会发展第十四个五年规划和 2035 年远景目标纲要》《“十四五”国家药品安全及促进高质量发 展规划》,做好《中国药典》2025 年版编制工作,切实提高药品质量,保障公众用药安全有效,促进医药产业高质量发展。
04.【CDE】关于公开征求《罕见疾病药物开发中疾病自然史研究指导原则》意见的通知
2022年12月21日,CDE官网发布关于公开征求《罕见疾病药物开发中疾病自然史研究指导原则》意见的通知,该指导原则旨在结合我国罕见疾病研究现状,提出符合我国国情的罕见疾病药物开发中疾病自然史研究的考虑要点,推动和规范我国罕见疾病的疾病自然史研究,征求意见时限为自发布之日起1个月。

05.【CDE】关于公开征求《预防用疫苗免疫原性桥接临床试验技术指导原则(征求意见稿)》意见的通知
2022年12月21日,CDE官网发布关于公开征求《预防用疫苗免疫原性桥接临床试验技术指导原则(征求意见稿)》意见的通知,免疫原性是预防用疫苗评价的重要手段之一,通过免疫原性桥接临床试验(简称免疫桥接试验),比较疫苗在不同条件下引起的免疫应答和安全性特征,可推测和借鉴疫苗的安全有效性。免疫桥接试验有特定的适用领域和设计特点,该指导原则旨在指导申请人科学和合理的开展规范的免疫桥接试验。
06.【CDE】关于公开征求ICH《S1B(R1):致癌性研究》实施建议和中文版意见的通知
2022年12月22日,CDE官网发布关于公开征求ICH《S1B(R1):致癌性研究》实施建议和中文版意见的通知,为期1个月。该指导原则由相应的 ICH 专家工作组制定,按照 ICH 进程,已通过药品监管机构讨论。在 ICH 进程第四阶段,最终该草案被推荐给欧盟、日本和美国的管理机构采纳。本增补文件是对S1指导原则(S1A、S1B和S1C(R2))的补充,而不是为了替代现行的S1B指导原则。


国际药政
01.【FDA】指南定稿 支持程序性细胞死亡受体1(PD-1)或程序性细胞死亡配体1(PD-L1)阻断抗体替代给药方案的基于药代动力学的标准
2022年12月16日,美国FDA 发布了“支持 PD-1 或 PD-L1 阻断抗体用于治疗癌症患者的替代给药方案的基于药代动力学的标准”定稿指南,帮助申办人寻求与根据原始临床疗效和安全性试验批准的当前静脉内给药方案不同的替代给药方案。程序性细胞死亡受体1(PD-1)或程序性细胞死亡配体1(PD-L1)阻断抗体目前已被开发用于各种癌症适应症。该定稿指南更新了一年前发布的同名指南草案,提供了一种基于药代动力学(PK)的方法,以支持PD-1/PD-L1阻断抗体产品在批准前和批准后的替代给药方案的批准。这种模式可能适用于 PD-1/PD-L1 单药疗法,以及仅提议改变 PD-1/PD-L1 剂量和/或给药方案的联合治疗方案。

02.【EDQM】EDQM 发布新版组织和细胞指南
2022年12月15日,欧洲药品质量管理局(EDQM)发布了更新后的指南。全面概述了领域内最新进展,以及确保应用于患者的人体组织和细胞的质量和安全的技术指南。
第5版指南分为四个部分,对所有章节进行了详细修订:
A部分涵盖了适用于所有参与组织和细胞捐赠、采购、检测、加工、保存、储存和分发的组织机构和组织的一般要求。
B部分介绍了不同人源物质的具体指南和要求。
C部分包含组织企业的良好实践指南。
D部分包含组织和细胞专论。
03.【FDA】FDA 批准首个针对高危卡介苗无反应性非肌层浸润性膀胱癌的腺病毒载体基因疗法
2022年12月16日,美国FDA批准nadofaragene firadenovec-vncg (Adstiladrin, Ferring Pharmaceuticals) 用于治疗卡介苗(BCG)无效的高危非肌层浸润性膀胱癌(NMIBC)的成人患者。ADSTILADRIN (nadofaragene firadenovec-vncg) 是一种基于非复制型腺病毒载体的基因疗法,通过膀胱灌注使用。

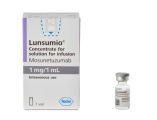
04.【FDA】加速批准 mosunetuzuab-axgb 治疗复发性或难治性滤泡性淋巴瘤
2022年12月22日,美国FDA加速批准Mosunetuzumab-axgb用于复发或难治性滤泡性淋巴瘤(FL)成年患者。Mosunetuzumab-axgb是一种双特异性抗体,可同时靶向CD20和CD3,能够起到T细胞连接器(T-cell engager)的作用。
部分图文来源于网络,侵联删
关于武汉珈创
武汉珈创生物技术股份有限公司,创建于2011年,是一家集生物技术服务与研发为一体的高新技术企业,专注于为生物药品/制品的生产企业及研发机构提供各类细胞(含重组细胞、干细胞、免疫细胞等)及原辅料的质量检测、病毒清除工艺验证技术服务。
END
